Ondas de materia: la hipótesis de De Broglie
 |
a hipótesis de Einstein había dejado al descubierto la naturaleza dual de la luz. La idea de que las ondas luminosas llevan asociadas partículas o cuantos de energía llamados fotones parecía consolidada con el apoyo de diferentes experimentos.
En este ambiente, el científico y aristócrata francés Luis de Broglie tuvo la sospecha de que la dualidad onda-corpúsculo avanzada para la luz, era una preferencia más general del mundo físico. La naturaleza, razonaba De Broglie, ama la simetría; luz y materia son dos formas simétricas, de modo que si las ondas luminosas se presentan en ocasiones como partículas, las partículas materiales deben tener alguna especie de onda asociada. Esta intuición extraordinaria atribuía a la materia propiedades ondulatorias que hasta entonces no habían sido nunca observadas por ningún científico.
De Broglie era un buen conocedor de la óptica y de la mecánica, y la idea de cuantificación desarrollada por Einstein en su teoría del fotón fue relacionada con la noción de onda estacionaria. Era un hecho establecido que una onda estacionaria, formada por reflexión entre dos límites, no puede presentar todo tipo de frecuencias: sólo una serie de ellas cuyas longitudes de onda son proporcionales a números enteros están permitidas. La longitud de onda, y por tanto la frecuencia de onda estacionaria, es una magnitud que está cuantificada, es decir, que varía a saltos y no de una forma continua. Las ondas podrían entonces describir la moderna idea de la cuantificación.
Afianzado con este tipo de razonamientos, De Broglie emprendió la búsqueda de una ecuación que definiera la onda asociada a una partícula en movimiento de masa m. La teoría de Einstein atribuía al fotón como partícula una cantidad de movimiento p igual a
|
que expresada en términos de longitud de onda toma la forma
|
De Broglie pensó que esa misma ecuación entre la longitud de onda luminosa 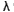 y la cantidad de movimiento p del fotón debería regir la relación, simétrica respecto de la anterior, entre la cantidad de movimiento de una partícula material y su onda asociada. La ecuación
y la cantidad de movimiento p del fotón debería regir la relación, simétrica respecto de la anterior, entre la cantidad de movimiento de una partícula material y su onda asociada. La ecuación
| (15.2) |
define la llamada longitud de onda de De Broglie y la onda correspondiente asociada a la partícula de masa m y velocidad v se denomina, genéricamente, onda de materia.
La teoría de las ondas de materia de De Broglie, presentada formalmente en 1924 en su tesis doctoral, fue aplicada pronto a los electrones de los átomos e hizo posible la explicación de multitud de fenómenos a nivel atómico.
El por qué las ondas de materia no pueden ser detectadas más que en el dominio atómico y subatómico es debido, según la ecuación de De Broglie, a la pequeñez de la constante de Planck (h = 6,63 · 10-34 J · s). Así, por ejemplo, un perdigón de 10 g de masa que se mueva a una velocidad de 10 m/s tiene una onda asociada cuya longitud l valdrá:
|
es decir, casi un cuatrillón de veces menos que el tamaño del átomo de hidrógeno.
Los espacios entre átomos en una red cristalina, por su pequeña distancia, fueron rendijas apropiadas para poner de manifiesto el fenómeno de la difracción de las ondas de materia predichas por De BroglieAplicación de la ecuación de De Broglie
n haz de electrones es emitido por un filamento incandescente y acelerado posteriormente sometiéndolo a una diferencia de potencial de 1 000 volts.
Determinar la longitud de onda del electrón al final del trayecto y expresaría en m y en Å. (Tómese la masa y carga del electrón respectivamente como me = 9,108 · 10-31 kg, e = 1,602 · 10-19 C y la constante de Planck h = 6,625 · 10-34 J · s.)
De acuerdo con la ecuación de De Broglie:
La cantidad de movimiento p está a su vez relacionada con la energía cinética mediante la expresión:
Por otra parte, la energía cinética final que adquiere el electrón es igual al trabajo W efectuado por el campo electrostático para acelerarlo. Es decir:
Ec = W = q · DV
siendo q la carga de la partícula y ∆V la diferencia de potencial eléctrico. Combinando las anteriores ecuaciones resulta:
Sustituyendo los datos disponibles y operando se tiene finalmente:
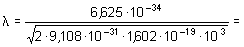
La difracción de partículas
Las ondas en general, cualquiera que sea su naturaleza, pueden doblar las esquinas y salvar los obstáculos; este fenómeno se conoce con el nombre de difracción. Las interferencias en general y la difracción en particular constituyen fenómenos típicos del comportamiento ondulatorio para los cuales no existe nada similar en el mundo de las partículas. Por tal motivo el hecho de que algo se difracte o sufra interferencias constituye una demostración de su naturaleza ondulatoria.
En 1927 Davison y Germer en los Estados Unidos y G.P. Thomson en Inglaterra, mediante experimentos diferentes, pusieron a prueba la hipótesis de De Broglie al intentar someter los electrones al test de la difracción. Era un hecho entonces conocido que para que se produzca el fenómeno de difracción de una onda con una rendija o por un conjunto de rendijas (red de difracción) es necesario que el tamaño de la abertura sea del mismo orden de magnitud que la longitud de onda empleada.
La predicción de la ecuación de De Broglie para un electrón con una energía de 54 electronvolts (1 eV = 1,6 · 10-19 J) consiste en una onda de materia asociada de 1,66 Å (1 Å = 10-10 m) de longitud de onda. Sobre la base de la experiencia acumulada en el estudio de los fenómenos de difracción de rayos X se pensó entonces que los átomos de un cristal cuya separación fuese de ese orden podrían servir de red de difracción para los electrones. Si la hipótesis de De Broglie era acertada, los electrones, como ondas de materia, deberían ser difractados por esa red cristalina.
Se eligió para el experimento un cristal de níquel, ya que sus átomos están ordenados en planos separados entre sí 0,91 Å. Se bombardeó la muestra de cristal de níquel con electrones de 54 eV de energía cinética y se observaron, efectivamente, fenómenos de difracción para determinadas orientaciones del haz incidente. Además, la aplicación de fórmulas típicas del fenómeno óptico de la difracción al análisis de los datos experimentales dio como resultado un valor de la longitud de las ondas difractadas igual, dentro del error experimental, al predicho por la ecuación de De Broglie, es decir,
= 1,66 Å.
La difracción de partículas (continuación)
l experimento crucial de Davison y Germer proporcionó, en su día, la primera comprobación experimental directa de la hipótesis de De Broglie sobre la existencia de ondas de materia asociadas a las partículas en movimiento.
Más adelante se lograron difractar partículas de mayor masa como neutrones o incluso átomos completos, eligiendo como red de difracción un cristal apropiado a las dimensiones de la longitud de la onda de materia asociada a la correspondiente partícula móvil.
Consolidada la teoría de De Broglie, la difracción de neutrones se ha convertido en una técnica física útil para la determinación de la estructura cristalina de los sólidos, es decir, la forma geométrico en la que sus átomos y, en particular, sus núcleos se distribuyen por el espacio formando el cristal.
Una interpretación para las ondas de materia
Las partículas subatómicas en movimiento se comportan también como ondas. Al igual que la luz, la materia a ese nivel microscópico es dual, presentándose unas veces en forma de ondas y otras en forma de partículas en función de la naturaleza del experimento montado para detectarla.
Una onda puede considerarse como una oscilación que viaja o se propaga por el espacio o por un medio material. Cabe entonces preguntarse cuál es la naturaleza de las ondas de materia, qué es lo que vibra en las ondas de De Broglie y qué relación existe entre el electrón como partícula y su onda asociada.
Las ondas de materia son ondas que, aun cuando tienen la misma forma matemática que las otras ondas, no tienen el mismo significado. Cumplen las leyes típicas del comportamiento ondulatorio, pero no corresponden a una propiedad física que se propague por el espacio. Son más bien ondas matemáticas o más exactamente ondas de probabilidad, porque en un punto cualquiera de su trayecto la amplitud de la onda de materia elevada al cuadrado define la probabilidad de encontrar a su partícula correspondiente en dicho punto.
Dado que en una onda de luz el cuadrado de la amplitud constituye una medida de la intensidad luminosa, la referencia a este tipo de ondas puede ilustrar la clase de relaciones que existen, en general, entre una partícula y su onda asociada.
Si en el experimento de interferencias de Young (o de las dos rendijas) se colocase en la pantalla un detector móvil de fotones que pudiese desplazarse de arriba abajo por la pantalla, se observaría cómo las franjas alternadas de máxima y mínima intensidad luminosa coinciden con las zonas en las que el detector registra un número alto y bajo (o nulo), respectivamente, de fotones. La intensidad de la onda luminosa en un punto de la pantalla da, pues, idea de la probabilidad de localizar al fotón en ese punto.
Si en lugar de utilizar una fuente de luz se empleara en el experimento una fuente de electrones, un detector apropiado (contador Geiger) al barrer de arriba abajo la pantalla arrojaría un número de cuentas por minuto cuyo valor variaría con la altura, de la misma forma que lo hace la intensidad de luz en el experimento de Young. O dicho en otros términos, si se representara gráficamente la variación del número de cuentas por minuto con la coordenada Y se obtendría una gráfica típica del fenómeno de interferencia. Los electrones llegan, pues, a la pantalla como partículas y es la probabilidad de llegada lo que se distribuye por aquélla del mismo modo que lo hace la intensidad de una onda.
Este resultado indica que la relación entre la onda de materia y el electrón correspondiente es de tipo estadístico o probabilístico. Éste es el secreto de esas relaciones enigmáticas y poco intuitivas que caracterizan la llamada dualidad onda-partícula.


No hay comentarios:
Publicar un comentario